L’explosion d’un mélange de gaz combustibles dans un cylindre de carton illustre la conversion d’énergie chimique en énergie cinétique avec apparition intermédiaire d’énergie interne.
Fiche d’accompagnement de l’expérience:
 Matériel
Matériel- un cylindre de carton (diamètre : 5 à 10 cm ; longueur : 30 à 50 cm) et les deux embouts correspondants
- de l’alcool à brûler ou de l’essence
- un bouchon ou un autre objet léger de petite taille
- un briquet ou des allumettes
- un poinçon ou un autre outil pointu
- éventuellement une agrafeuse ou de la colle
 Montage et réalisation
Montage et réalisationPercer un trou (diamètre approximatif : 5 mm) dans l’un des embouts du tube puis fixer solidement cet embout sur le tube de carton (utiliser éventuellement une agrafeuse ou bien de la colle).
Introduire quelques millilitres d’alcool à brûler ou d’essence dans le cylindre (1 à 2 ml par litre de capacité du cylindre) puis mettre en place le deuxième embout sur le cylindre sans le fixer.
Bien agiter le cylindre (le bouchon permet d’obtenir un meilleur mélange des gaz).
Présenter ensuite une allumette devant le trou percé dans l’embout fixe (voir la figure précédente).
On entend une explosion violente qui projette l’embout mobile à travers la pièce.
Veiller à ne pas diriger l’ouverture vers des personnes ou vers des objets fragiles.
Veiller également à ce que l’embout soit suffisamment mobile pour que le cylindre de carton n’explose pas.
 Explications
ExplicationsLors de la combustion des gaz combustibles (alcool à brûler ou essence) l’énergie chimique emmagasinée se transforme en énergie interne.
L’embout mobile reste sur le cylindre jusqu’à la fin du processus de combustion en raison de son inertie et parce que la déflagration des gaz à l’intérieur du cylindre est extrêmement rapide.
Le volume V des gaz enfermés dans le cylindre reste donc constant pendant la combustion.
D’après le premier principe de la thermodynamique, la variation d’énergie interne du mélange gazeux est:
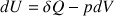
car le volume est constant, c’est-à-dire
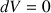
(p : pression dans le cylindre ; 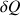 : chaleur reçue due à l’énergie chimique).
: chaleur reçue due à l’énergie chimique).
Il y a donc augmentation de l’énergie interne du mélange gazeux.
En supposant que le nombre N de molécules reste à peu près constant, et que les gaz se comportent comme des gaz parfaits diatomiques il en résulte que :
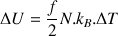
d’où une augmentation de pression :
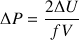
(N : nombre total de molécules ; 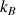 :constante de Boltzmann ; T : température absolue ; f : nombre de degrés de liberté des molécules gazeuses ( f = 5 pour les gaz diatomiques dioxygène et diazote)).
:constante de Boltzmann ; T : température absolue ; f : nombre de degrés de liberté des molécules gazeuses ( f = 5 pour les gaz diatomiques dioxygène et diazote)).
L’embout mobile ne résiste pas à l’augmentation de pression : il se détache du cylindre et il est projeté vers l’extérieur.
Le cylindre ne bouge pratiquement pas car sa masse est beaucoup plus grande que celle de l’embout (de plus il est tenu par la main de l’expérimentateur).
Dans cette transformation il y a conversion de l’énergie interne du mélange gazeux en énergie cinétique de l’embout.
Si cette expérience est spectaculaire, c’est parce que la pression pour laquelle l’embout est projeté est bien supérieure à la pression critique qui serait nécessaire pour simplement séparer l’embout du cylindre.
Ceci est dû d’une part à l’augmentation rapide de la pression et d’autre part à l’inertie de l’embout.
Si la pression augmentait doucement l’embout se détacherait doucement lorsque la pression critique serait atteinte et il tomberait sur le sol de façon tout à fait banale.

